2017-11-21
ボストン・サイエンティフィック、2017年第3四半期決算発表
(このプレスリリースは、2017年10月26日に米国ボストン・サイエンティフィック社が発表したプレスリリースを翻訳したものです。)
ボストン・サイエンティフィック (本社:マサチューセッツ州マールボロ)、NY証券取引所略号:BSX)は本日(2017年10月26日)、2017年10月30日締め第3四半期売上高が22億2,200万ドルになったことを発表しました。売上は前年同期比で、財務報告ベースで5.6%、為替変動の影響を除く実質ベースで5.7%上昇しました。当四半期の利益はGAAPベースで2億8,300万ドル(前年同期は2億2,800万ドル)、1株当たり利益(EPS)は0.20ドル(前年同期は0.17ドル)を計上しました。1株当たり調整後利益は前年同期比の0.27ドルから0.31ドルに上昇しました。
ボストン・サイエンティフィック社長兼CEOのマイク・マホーニーは次のように述べています。
「当社のグローバルチームは優れた業績を達成し続けています。私たちが進めている革新的な製品ポートフォリオへの継続的投資と、高成長市場への事業拡大がそれを支えています。私たちは社員の献身的な取り組みとウィニング・スピリットに感謝しています。特にプエルトリコの社員は、先頃現地を襲ったハリケーン災害の影響が続く中、顧客や患者さんのニーズに応えるために懸命な努力を続けています。」
第3四半期業績と主な取り組み
• 第3四半期の売上高は22億2,200万ドルを達成。当社発表の予想レンジは21億8,000万~22億1,000万ドル。財務報告ベースで前年同期比5.6%の増加、実質ベースで前年同期比5.7%の増加。
• 既存ビジネスの第3四半期成長率は前年同期比4.3%の増加(為替変動の影響ならびにエンドチョイス社(EndoChoice Holdings, Inc.)およびシメティス社(Symetis SA)の買収による売上を除く)
• GAAPベースの1株当たり利益は、当社予想の0.16~0.18ドルに対し、0.20ドル。調整後の1株当たり利益は、当社予想の0.29~0.31ドルに対し、0.31ドル。
• 第3四半期は全事業部門で前年同期比売上増を達成。部門別内訳は以下のとおり。
oメドサージ:財務報告ベース10.2%増、実質ベース10.3%増、既存ビジネス8.0%増
oカーディオバスキュラー:財務報告ベース4.1%増、実質ベース4.5%増、既存ビジネス2.8%増
oリズムマネジメント:財務報告ベース1.5%増、実質ベースおよび既存ビジネス1.2%増
• 地域別でも全地域で前年同期比売上増を達成。内訳は以下のとおり。
o 米国:財務報告ベースおよび実質ベース4.2%増、既存ビジネス2.8%増
o 欧州:財務報告ベース11.4%増、実質ベース8.8%増、既存ビジネス5.3%増
o AMEA(アジア太平洋、中東およびアフリカ):財務報告ベース4.6%増、実質ベースおよび既存ビジネス7.8%増
o 新興国市場1:財務報告ベースおよび実質ベース18.3%増、既存ビジネス18.0%増
• プエルトリコ国ドラドの当社製造施設が、ハリケーン「マリア」発生後の操業を再開。当社からは被災社員への人道支援や、総額200万ドルの慈善基金設置等の支援を実施。
• 米国で植込み型除細動器(ICD)および心臓再同期治療除細動器(CRT-D)システムのRESONATE™のMRIラベルのFDA承認を取得し、発売を発表。これらのHeartLogic™心不全診断装置、業界をリードするEnduraLife™バッテリー・テクノロジーおよびSmartCRT™テクノロジーと組み合わせて使用することで、1人1人の患者さんに適したきめ細かな治療が可能になる。
• 最新臨床試験として実施したMultiSENSE試験から得た新データを、米国心不全学会(Heart Failure Society of America)の第21回年次学術集会で発表。HeartLogic™心不全診断装置を使用することにより、患者さんの心不全発症リスクが高まっていた時期を特定する能力が一般的に用いられている血液検査よりも有意に拡大することが確認された。
• アパマ・メディカル社(Apama Medical, Inc.)を買収。同社は、心房細動治療用のシングルショットのApama高周波(RF)バルーン・カテーテル・システム2を開発する株式非公開会社。買収金額は、買収時の前払金1億7,500万ドルおよびその後の条件付支払金(成功報酬)最大1億2,500万ドル。
• 欧州心臓血管IVR学会(Cardiovascular and Interventional Radiological Society of Europe)会議において、MAJESTIC試験の3年目の転帰を発表。ELUVIA™薬剤溶出型血管ステントシステム3を使用して大腿膝窩動脈治療を受けた患者さんのうち、標的病変再血行再建(TLR)を回避した患者さんが85.3%を占めた。これにより、血管閉塞に対する回復再手術の必要が生じる確率が低下することが明らかになり、治療効果の長期持続性が証明された。
• ACURATE™ neo経心尖大動脈弁システム4がCEマークを取得し、2017年第4四半期中に欧州全域で限定的に市場導入開始の予定。本製品はACURATE™ neo大動脈弁用の二次デリバリーシステムで、経大腿デリバリーシステムと共に承認を取得した。
• WATCHMAN™ LAAC装置のDFUの改訂版が欧州でCEマークを取得。これにより、装置植込み後の経口抗凝固薬投与期間と二重抗血小板療法による治療期間の短縮が可能になる。さらに、オーストラリアでWATCHMAN™ LAAC装置に対する民間医療保険による医療費償還が承認された。WATCHMAN™ LAAC 装置の植込み実績が世界合計で40,000件に達した。
• FDAから、アメリカン・メディカル・システムズ社(American Medical Systems, LLC)に対する警告書の解除通知を受領。同警告書は2014年8月に発行されたもの。その後の施設査察と是正処置によって満足な結果が確認され、警告解除となった。
• 当社のPrecision Spectra™、Novi™およびMontage™脊髄電気刺激(SCS)システムがFDAから適応拡大承認を取得し、複合性局所疼痛症候群(CRPS)に伴う胴や手足の慢性難治性疼痛の管理にも使用できるようになった。さらに、FDAから表示の適用範囲拡大も承認され、当社以外の一部のリードを埋め込んだ患者さんにも本システムを使用できるようになった。
• 当社の「重症持続型喘息(PAS2)に対する気管支サーモプラスティ(BT)の評価を目的とするFDA承認後臨床試験」実施後3年目のフォローアップ・コホート研究から得た新データを発表。重症喘息に対するBT治療の有効性、効果持続性、安全性が改めて立証された。
第3四半期の純売上高
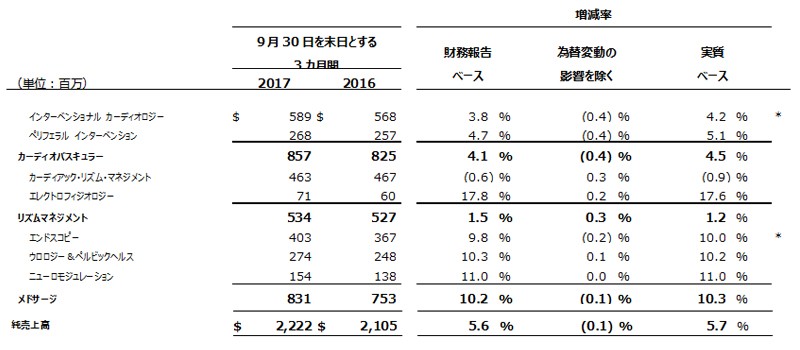
*インターベンショナル カーディオロジーは既存ビジネスベースで1.7%増加。エンドスコピーは既存ビジネスベースで5.4%増加。
成長率は四捨五入していない実数値であり、再計算する際に誤差が生じる場合があります。
売上成長率は、外国為替の変動による影響および/または多額の売上を伴う最近の買収の影響を除いたものであり、米国のGAAP(一般会計原則)に従って作成されていません。
現在予想される2017年通年の売上は89億8,500万~90億1,500万ドルの範囲(前回発表の予想は88億9,000万~89億9,000万ドル)で、財務報告ベースでは前年比およそ7~8%増、エンドチョイスおよびシメティスによるおよそ120ベーシスポイントの貢献を含めた実質ベースでは前年比およそ7%増に相当します。現在予想されるGAAPベースの利益は、1株当たり0.71~0.75ドルの範囲(前回発表の予想は1株当たり0.70~0.74ドル)であり、無形資産減損費用、買収関連・組織再編・組織再編関連および訴訟関連の純費用、投資による若干の減損、ならびに減価償却費用を除いた調整後利益は、1株当たり1.24ドル~1.27ドルの範囲になる見込みです(前回発表の予想は1株当たり1.23~1.27ドル)。
現在予想される2017年第4四半期の売上は23億4,500万~23億7,500万ドルの範囲で、財務報告ベースでは前年同期比およそ7~8%増、エンドチョイスおよびシメティスによるおよそ130ベーシスポイントの貢献を含めた実質ベースでは前年同期比およそ5~6%増になる見込みです。GAAPベースの利益は、1株当たり0.19~0.23ドルの範囲になる見込みです。買収関連、組織再編および組織再編関連の純費用、ならびに減価償却費用を除いた調整後利益は1株当たり0.32~0.35ドルの範囲になる見込みです。
ボストン・サイエンティフィックについて
将来予測に関する記述についての注意事項
このような相違をもたらす可能性のあるリスクや不確実要素の例として、将来の経済、政治、競争、医療費償還および法規制の条件、新製品導入、市場における新製品受容、製品市場、市場の価格動向、予想される手術件数、企業・事業の買収や統合、臨床試験結果、人口統計学的動向、知的所有権、訴訟、金融市況、組織再編プログラムの実施とその効果、当社経営戦略(コスト削減計画・成長計画を含む)の実施とその効果、当社および競合他社の将来的な経営上の意思決定などがあります。新たなリスクや不確実要素は随時発生の可能性があり、予測が困難です。これらの要因すべてを正確に予測することはほとんど不可能であり、その多くは当社の制御の及ばないものです。当社の将来的な経営に影響する可能性のあるこれらの要因およびその他の重大なリスクの一覧およびその詳細説明につきましては、米国証券取引委員会に提出した最新の10-K 年次報告書パート I 1A 項目「危険因子」をご参照ください。なお、この内容は、提出済みもしくは今後提出する10-Q 四半期報告書パート II 1A 項目「危険因子」で更新される場合があります。本プレスリリース発行後に当社の予測に変化が生じた場合、または予測の根拠となった事象、条件、状況に変化が生じた場合、または将来予測と実際の結果に相違をもたらす原因となる変化が生じた場合においても、当社は将来予測に関する記述内容を公開の場で更新または改訂する予定はなく、その義務を一切否認します。本注意事項は本プレスリリースに記載された将来予測に関するすべての記述に適用されます。
非GAAPによる財務情報の使用
連絡先:
ケイト・ハラニス
508-683-6585(オフィス)
メディア・リレーションズ
スーザン・リサ, CFA
508-683-5565(オフィス)
投資家向け情報担当
1. 「新興国市場」の定義について:各国の経済状況、医療部門の状況、および当社の国際経営力を考慮の上、高い成長性を持つと当社が判断した国々を「新興国市場」と定義しています。現時点では20カ国がこの定義に該当します。
2. 現在開発中です。販売されていません。
3. CEマーク取得済製品です。米国での表示:「注意:本製品は治験用医療機器です。連邦(または米国)法により、治験目的に限り使用が認められています。販売されていません。」
4. CEマーク取得済製品です。ACURATE neo/TF™大動脈弁システムは、米国では使用または販売されていません。