アーティクルサマリー
BSCCI vol.12
One-Year Results of the OPTIVUS-Complex
PCI Study Multivessel Cohort
背景
方法
Study population
OPTIVUS-Complex PCI studyは、事前に設定されたステント拡張基準(OPTIVUS criteria)に従ったIVUSguided PCIが行われる患者を登録する前向き多施設のシングルアーム研究である。左前下行枝を含む多枝病変へのPCI患者を登録したmultivessel cohortと、左冠動脈主幹部病変へのPCI患者を登録したleft main cohortがあり、今回はmultivessel cohortの1年追跡結果を報告する。2019年3月から2021年4月の間に1134人の患者がスクリーニングされ、実際に多枝病変に対してIVUS-guided PCIが行われた1023人が登録された。同意撤回された2人を除き、1021人を解析対象集団とした。
OPTIVUS criteria and Study recommendations
OPTIVUS criteria のステントの拡張基準は次のように定義された:ステント長が28mm以上の場合はminimum stent area > distal reference lumen area、ステント長が28mm未満の場合はminimum stent area > 0.8*(proximal + distal reference lumen area)/2。これらの基準はIVUS-XPL試験および欧州のコンセンサスドキュメントを基に設定された。コアラボにて、定量的冠動脈造影(QCA)およびIVUS解析が行われた。
OPTIVUS criteriaに加えて、以下のcontemporary PCI practiceが推奨された:新世代DESの使用、stress imagingやphysiologyに基づくPCI 対象病変選択、橈骨動脈アプローチ、dedicated CTO operatorによるCTOPCI、高度石灰化病変に対するatherectomy deviceの使用、分岐部病変に対するproximal optimization technique、2ステントが必要な分岐部病変に対するfinal kissing balloon inflation、無症状患者に対してはroutine follow-up CAGは行わない、日本の承認最大用量のストロングスタチン使用、short DAPT。
主要エンドポイントおよび評価法
主要エンドポイントは総死亡、心筋梗塞、脳卒中、全ての冠血行再建の複合エンドポイントとした。本研究はシングルアーム研究であり、事前に設定されたperformance goalとの比較を主要エンドポイントの評価法とした。2005年~2007年(第1世代DES時代)の初回冠血行再建患者を連続登録したCREDO-Kyoto registry cohort-2の中から本研究のinclusion criteriaを満たすPCI群およびCABG群のイベント率をそれぞれperformance goalとした(PCI performance goal=27.5%, and CABG performance goal=13.8%)。また探索的解析として、2011年~2013年(新世代DES時代)の初回冠血行再建患者を連続登録したCREDO-Kyoto registry cohort-3を歴史的コントロールとし、propensity score matchingを用いた比較も行った。
結果
患者背景
平均年齢は71.2歳、78.6%が男性、14.2%が急性冠症候群であった(表1)。糖尿病の割合が54.8%、高出血リスクの割合が52.8%であった。手技に関しては、橈骨動脈アプローチの割合が87.5%であった。3枝病変の割合は20.4%、平均SYNTAX score は18.1であり、78.5% の患者はlow SYNTAX scoreであった。コアラボで評価されたOPTIVUS criteriaに関しては、全てのステント留置病変で達成できた患者が40.1%であり、患者の40.9%は少なくとも1つの病変でOPTIVUSの基準を満たしていなかった。また、いずれの病変でも達成できなかった患者が18.9%であった。退院時のP2Y12阻害薬は55.1%がクロピドグレル、44.3%がプラスグレルであった。スタチンの処方率は91.7%、日本の承認最大用量のストロングスタチン処方率は36.6%であった。
QCAおよびIVUSのコアラボ解析
コアラボでのQCA解析では、平均病変長が23.5mm、平均参照血管径は2.6mmであった(表2)。手技後のIVUS解析では、mean proximal reference lumen area が8.3mm2、mean minimum stent area が5.7mm2、mean distal reference lumen areaが5.8mm2であった。OPTIVUS criteriaの病変単位の達成率は61.0%であった。CREDO-Kyoto registry cohort-3のPCI群と比較すると、OPTIVUS群で前拡張および後拡張の施行率が高く、バルーンサイズも大きかった。OPTIVUS criteria の達成率はOPTIVUSの方が数値的には高いが、統計学的有意差には至らなかった(61.0% versus 55.2%, P=0.09)。一方、minimum stent areaはOPTIVUSで有意に大きかった(5.7mm2 versus 5.3mm2, P=0.02)。
OPTIVUS群において、OPTIVUS criteriaが達成できた病変と達成できなかった病変を比較すると、OPTIVUS criteriaが達成できなかった病変は、平均病変長が長く、分岐部病変や石灰化病変の割合が高かった(表3)。OPTIVUS criteriaを達成できなかった病変は、後拡張の施行率が高く、バルーンサイズも大きかった。IVUS解析では、OPTIVUS criteriaを達成できた病変は、minimum stent areaが大きかったが(5.7mm2 versus 5.5mm2)、proximalおよびdistal reference lumen areaは小さかった。
DAPTの中止率
OPTIVUSにおける1年のDAPT中止率は、CREDO-Kyoto registry cohort-3のPCI群と比較して高かった(69.5% versus 20.2%)(図1)。DAPT中止後にP2Y12阻害薬単剤を選択した患者は、CREDO-Kyoto registry cohort-3は18.3%であったのに対して、OPTIVUSでは60.8%であった。
Follow-up CAGの施行率
OPTIVUSのfollow-up CAG施行率は、CREDO-Kyoto registry cohort-3のPCI群と比較して低かった(17.8% versus 63.5%)(図2)。
Clinical outcomes
Primary endpointの1年イベント率は10.3%(95%信頼区間:8.4%-12.2%)であり、CREDO-Kyoto registry cohort-2から算出されたPCI performance goal (27.5%)よりも有意に低く(P<0.001)、CABG performance goal(13.8%)よりも数値的に低かった( 図3)。冠血行再建がprimary endpointの主な構成要素であった(表4)。Primary endpoint およびsecondary endpoints の発生率はOPTIVUS criteria達成の有無で大きな差はなかった(表4)。
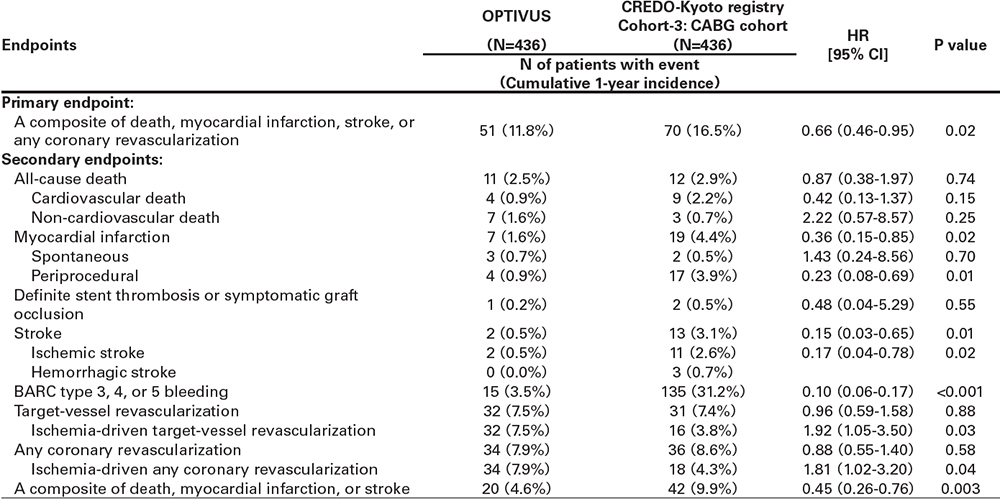
OPTIVUSとCREDO-Kyoto registry cohort-3のpropensity score matchingを用いた比較の結果を表5と表6に示す。OPTIVUSは、CREDO-Kyoto registry cohort-3のPCI群と比較して有意にprimary endpointのイベント率が低く(10.4% versus 23.3%, P<0.001)、これは手技起因性心筋梗塞および冠血行再建のイベント率の低さに基づくものであった(表5)。また大出血のイベント率も有意に低かった(3.3% versus 7.0%, P<0.001)。OPTIVUSは、CREDO-Kyoto registry cohort-3のCABG 群と比較して有意にprimary endpointのイベント率が低く(11.8% versus 16.5%, P=0.02)、これは手技起因性心筋梗塞および脳卒中のイ ベント率の低さに基づくものであった(表6)。全ての冠血行再建のイベント率に関しては同等の結果であった(7.9% versus 8.6%, P=0.58)。
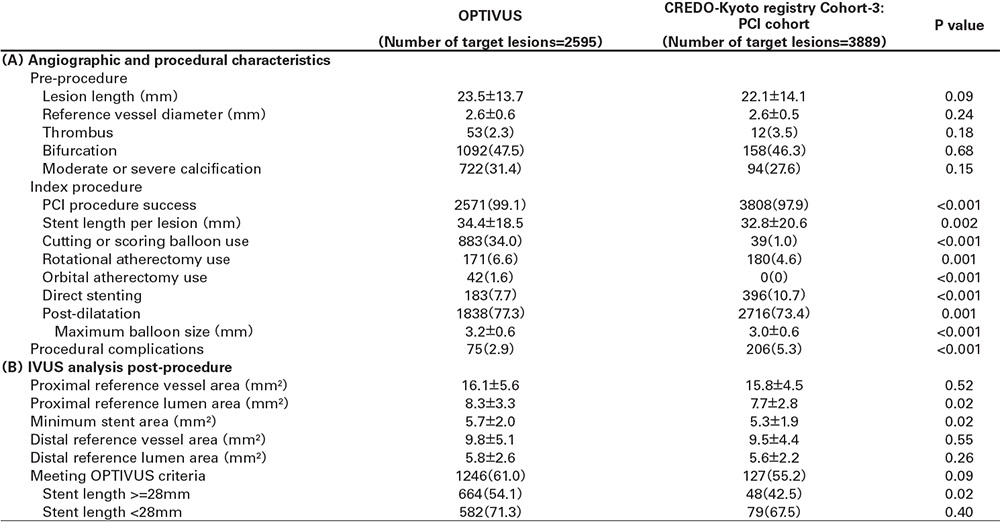
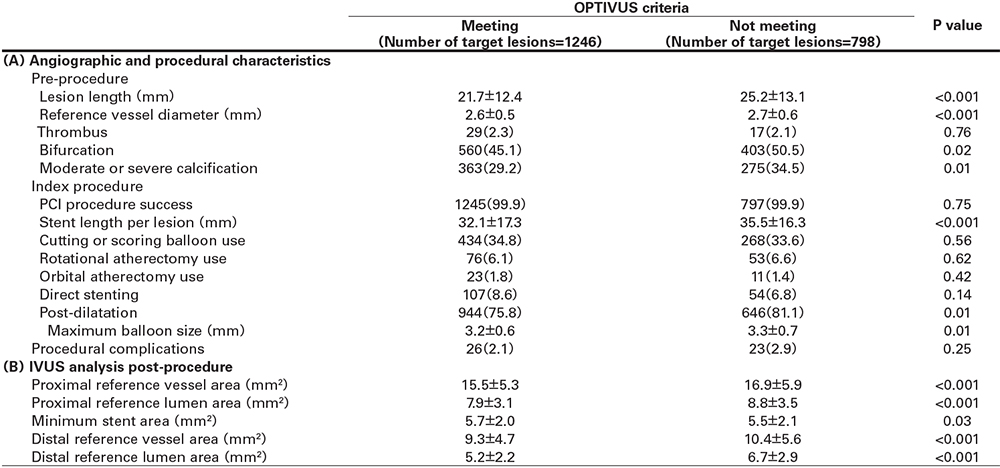
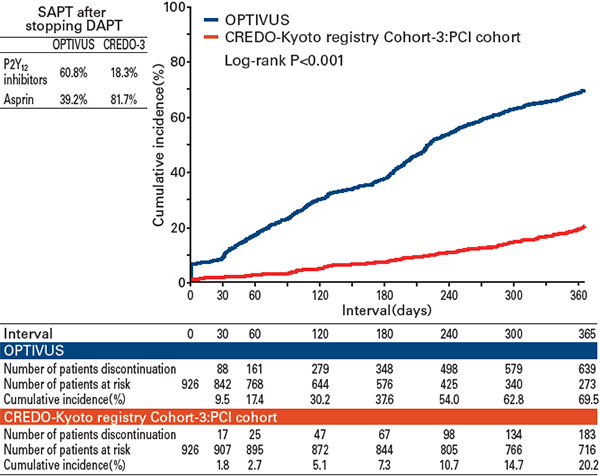
図1 DAPT中止率のカプランマイヤー曲線およびDAPT中止後の抗血小板薬の種類
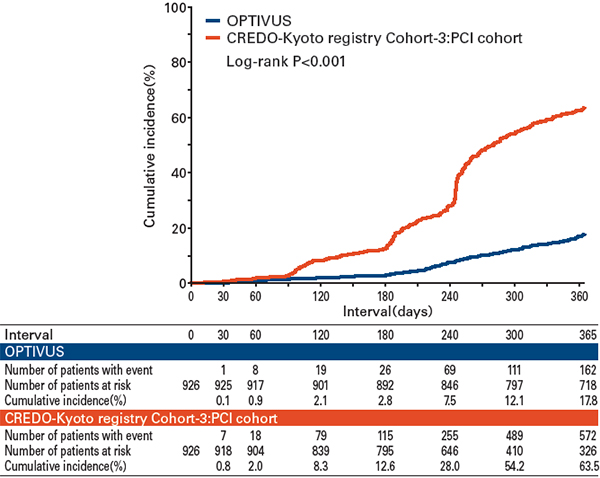
図2 Follow-up CAGのカプランマイヤー曲線
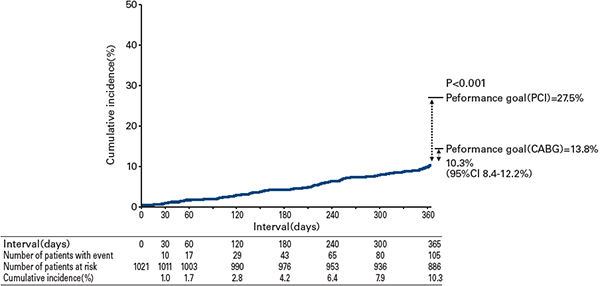
図3 Primary endpointのカプランマイヤー曲線
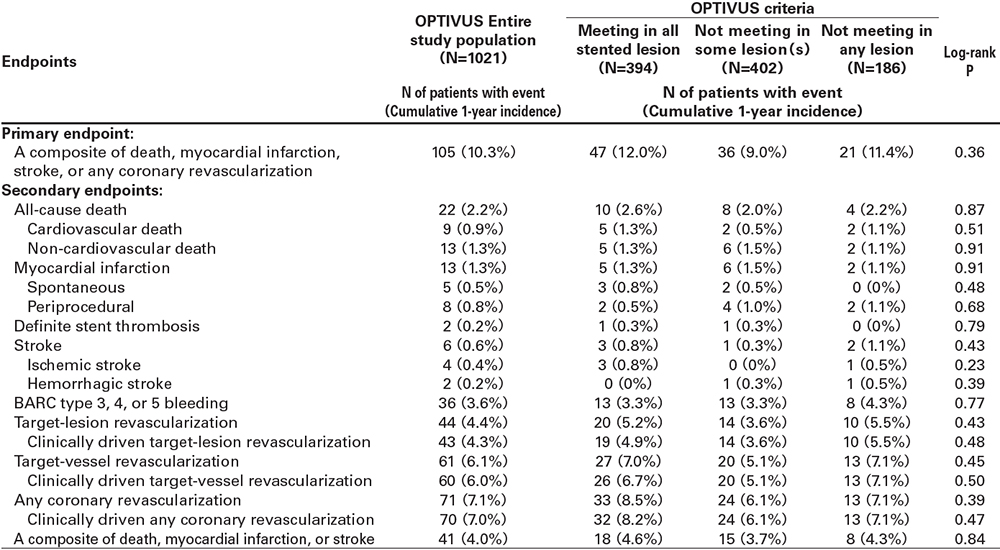
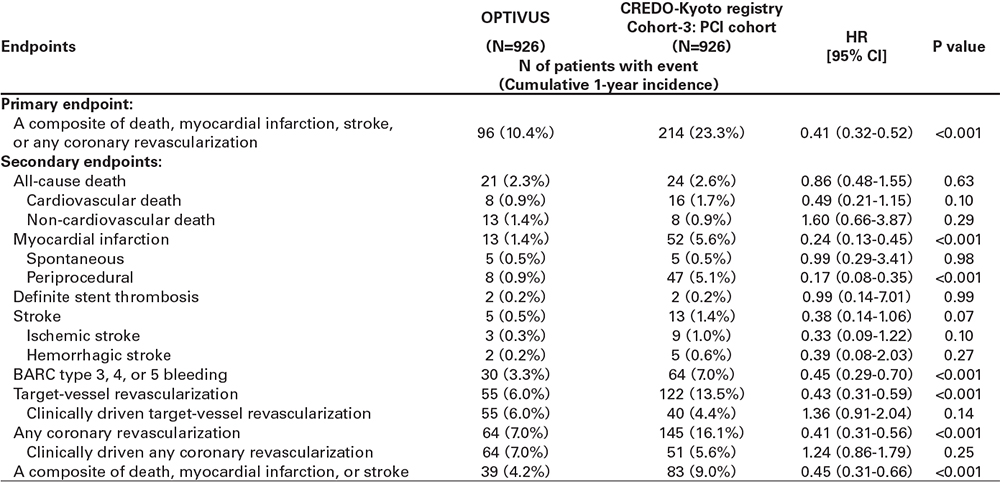
考察
SYNTAX-Ⅱ試験では、SYNTAX Ⅱ strategy(physiology-guided PCI、new-generation DES、IVUS-guided PCI、contemporary CTO technique、guideline-directed medical therapy)を用いたPCIは、SYNTAX-Ⅰ試験のPCI群と比較して優れた臨床成績であり、またSYNTAX-Ⅰ試験のCABG群と同等の臨床成績であるこ とが報告された。OPTIVUS-Complex PCI studyの基本コンセプトおよび研究デザインはSYNTAX-Ⅱと類似しており、本研究は至適なIVUS-guided PCI および我が国のcontemporary PCI practiceを取り入れた「Japanese style SYNTAX-Ⅱ study」と呼べるものである。結果はSYNTAX-Ⅱ試験と基本的に一貫しており、OPTIVUSは、SYNTAX-Ⅰ試験と同時期(2005年~2007年)に行われたCREDO-Kyoto registry cohort-2から計算されたPCIお よびCABG performance goalと比較して優れた臨床成績であった。また探索的解析として行った新世代DES時代のCREDO-Kyoto registry cohort-3(2011年~2013年)のPCI群およびCABG群との比較においても、OPTIVUSの優越性は保たれていた。
OPTIVUSはCREDO-Kyoto registry cohort-3のPCI群と比較して、atherectomy deviceの使用率や前拡張および後拡張の施行率が高く、バルーンサイズも大きかった。これらのpracticeがOPTIVUS群の大きなminimum stent areaにつながったと考えられる。Intensiveなステント拡張は合併症のリスクがあるが、OPTIVUSではCREDO-Kyoto registry cohort-3のPCI 群よりも手技合併症、手技起因性心筋梗塞の発生率は低く、至適なIVUS-guidanceによってアグレッシブかつ安全なstent optimizationが可能になり、心筋梗塞や冠血行再建のイベント率低下につながったのではないかと考えられる。OPTIVUSの良好な臨床成績は至適なIVUS-guided PCIだけでなく、承認最大用量のストロングスタチン処方やfollow-up CAGの少なさによる影響も大きいと考えられる。また、OPTIVUS ではCREDO-Kyoto registry cohort-3のPCI群と比較して大出血のイベント率も低かったが、これらは橈骨動脈アプローチの高い使用率やshort DAPTの効果が考えられる。至適なIVUS-guided PCIに加えて現代の進化したPCI practiceを集学的に行うことが、多枝病変PCI患者の予後改善およびCABGの代替治療への進化に重要であると思われる。
OPTIVUS criteriaの達成の有無で臨床成績に大きな差が表れなかったことは、我々としては少し予想外の結果であった。原因の一つとして考えられるのは、OPTIVUS criteriaを達成できなかった病変のmean minimum stent areaが5.5mm2とかなり大きい点である。OPTIVUS criteriaを達成できなかった病変の方が後拡張の施行率は寧ろ高く、参加施設 のPCI術者は、例えOPTIVUS criteriaを満たせなかったとしても、安全性に支障のない範囲で最大限ステント拡張を行っていると考えられ、これらのpracticeがOPTIVUS criteria達成患者と同等の臨床成績につながった可能性がある。Reasonable なステント拡張を得ることができれば、OPTIVUS criteria達成の有無は、その後の臨床成績に大きく影響を与えないのかもしれない。またそもそも、OPTIVUS criteriaが将来のイベントを予測する適切なtargetではない可能性も考えられる。OPTIVUS criteria のようなconventional stent expansion criteria(minimum stent areaとreference lumen areaを比較する方法)は将来のイベント予測に有用ではないことが、複数の観察研究で報告されている。将来のイベント予測が可能な適切なtarget となるstent expansion criteriaの探索が必要である。
本研究のlimitationとしては以下の点が挙げられる:(1)本試験はランダム化比較試験ではないので、至適なIVUSguided PCI自体が実際にどの程度臨床成績に影響したかは不明である (2)介入研究と比較対象のall-comer registryでは患者背景が異なり、本研究のstudy populationは低リス ク患者がselectされている可能性がある (3)CABGとの比較を考えた時に1年という追跡期間は十分に長いものではない。
論文ポイント
- 本研究はJapanese style SYNTAX-Ⅱ studyと呼べるものであり、至適なIVUS-guided PCIに加えて現代の進化したPCI practiceを集学的に行うことが、多枝病変PCI患者の予後改善およびCABGの代替治療への進化に重要であると思われる。
- 至適なIVUS-guided PCIのtargetとなるstent expansion criteria の検討が必要である。












 PDFを開く
PDFを開く